Xembify 是一种皮下免疫球蛋白 (SCIG)。它含有广谱 抗体 (免疫球蛋白)从大量人体血浆中提取。
Xembify是20%免疫球蛋白溶液 经 FDA 批准,该药物可用于治疗原发性体液免疫缺陷症,并可用于治疗多种其他疾病。
获取您的 Xembify 剂量
与专家交谈Xembify 里面有什么?
Xembify 是一种无热原即用型无菌产品。 该溶液含有IgG(18-22%蛋白) 存在于 0.16 M 至 0.26 M 甘氨酸和约 10 – 40 mcg/ml 聚山梨醇酯中。
Xembify 不含任何防腐剂,也不由橡胶乳胶制成。
它看起来像什么?
Xembify 为无色至淡黄色溶液,几乎透明或略带乳白色。
Xembify 如何工作?
Xembify提供多种 免疫球蛋白(Ig) 具有调理作用(更容易被破坏)和中和作用的物质。细菌、病毒、寄生虫、支原体及其释放的毒素都能被Xembify中的抗体中和。
Xembify 共付额援助
Xembify存储
Xembify 需冷藏保存(2-8 摄氏度)。也可在室温下保存,保质期最长可达 6 个月,有效期至有效期结束。请勿冷冻。
如果冷藏,请将 Xembify 恢复至室温后再使用。请勿用微波炉加热。
治疗/疗法
Xembify 已获得 FDA 批准,用于治疗 2 岁及以上患者的原发性体液免疫缺陷。这包括但不限于先天性无丙种球蛋白血症、常见变异性免疫缺陷 (CVID)、X 连锁无丙种球蛋白血症、Wiskott-Aldrich 综合征以及严重联合免疫缺陷。
原发性体液免疫缺陷(PI)
免疫系统功能欠佳 原发性体液免疫缺陷 患者可能会受到损害。使用 Xembify 治疗可以显著增强免疫系统,改善生活质量。
禁忌症
尽管Xembify具有广泛的耐受性和接受度,但仍有一些情况是Xembify给药的禁忌症。以下列出了其中一些情况。
过敏反应
Xembify 不得用于对人免疫球蛋白有过敏反应或严重过敏反应的候选人。此类过敏反应的主要表现包括:
- 呼吸困难
- 颈部肿胀
- 严重皮疹
- 肢端发绀(四肢发蓝)
如果出现上述症状,您应该立即就医。
如果您以前遇到过此类问题 免疫球蛋白,那么您一定不能使用 Xembify。
IgA缺乏症
你应该远离 Xembify 或任何其他 免疫球蛋白 如果您缺乏IgA,则无需输液。这是因为IgA缺乏的人通常会产生抗IgA抗体。因此,身体会产生超敏反应,有时甚至可能致命。
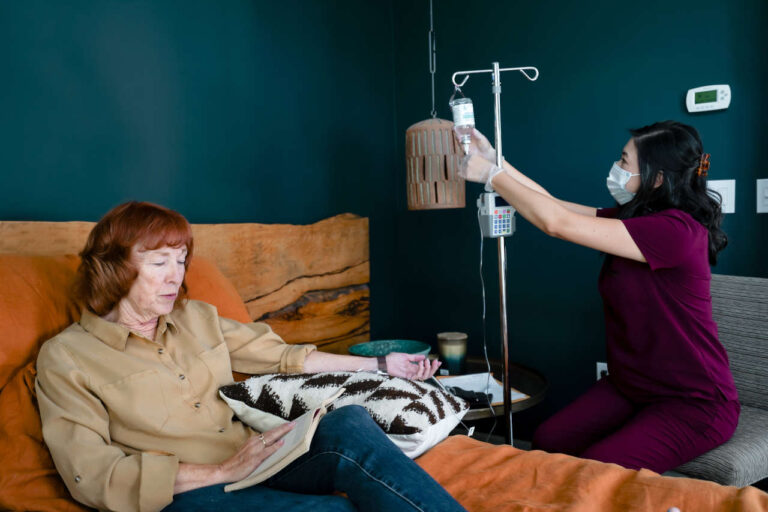
皮下输注
不像 IVIG疗法,均通过静脉注射,而 Xembify 仅通过皮下途径给药。
剂量
Xembify的剂量取决于患者的药代动力学和临床反应。我们采用以下顺序来确定合适的剂量。
- 开始Xembify治疗后,最早在5周内测量患者血清IgG谷水平。
- 每 2 至 3 个月继续监测 IgG 谷水平,以确定是否需要进行任何后续剂量调整。
- 对于频繁给药(即每周两到七次),将计算出的每周剂量除以每周所需的输注次数。
笔记: 如果患者对 Xembify 治疗未能维持足够的临床反应(或血清 IgG 水平未达到既往治疗水平),则可能需要调整剂量。调整剂量时,医生会计算 IgG 谷浓度与目标 IgG 谷浓度之间的差值,然后通过下表计算差值:
剂量调整(毫升/周)
| 与目标 IgG 谷浓度的差异 (mg/dl) | 10公斤 | 15公斤 | 20公斤 | 30公斤 | 40公斤 | 50公斤 | 60公斤 | 70公斤 | 80公斤 | 90公斤 | 100公斤 | 110公斤 | 120公斤 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 50 | 0 | 1 | 1 | 1 | 2 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 5 |
| 100 | 1 | 1 | 2 | 2 | 3 | 4 | 5 | 5 | 6 | 7 | 8 | 8 | 9 |
| 150 | 1 | 2 | 2 | 3 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 13 | 14 |
| 200 | 2 | 2 | 3 | 5 | 6 | 8 | 9 | 11 | 12 | 14 | 15 | 17 | 18 |
| 250 | 2 | 3 | 4 | 6 | 8 | 9 | 11 | 13 | 15 | 17 | 19 | 21 | 23 |
| 300 | 2 | 3 | 5 | 7 | 9 | 11 | 13 | 16 | 18 | 20 | 23 | 25 | 27 |
| 350 | 3 | 4 | 5 | 8 | 11 | 13 | 16 | 19 | 21 | 24 | 27 | 29 | 32 |
| 400 | 3 | 5 | 6 | 9 | 12 | 15 | 18 | 21 | 24 | 27 | 30 | 33 | 36 |
| 450 | 3 | 5 | 7 | 10 | 14 | 17 | 20 | 24 | 27 | 31 | 34 | 38 | 41 |
| 500 | 4 | 6 | 8 | 11 | 15 | 19 | 23 | 27 | 30 | 34 | 38 | 42 | 45 |
根据患者的体重找到增加/减少每周剂量的相应量(以毫升为单位)。
例子: 如果体重70公斤的患者,IgG谷浓度为900毫克/分升,而目标浓度为1000毫克/分升,则两者相差100毫克/分升。因此,每周剂量应增加5毫升。
安全 Xembify 管理
获得事先授权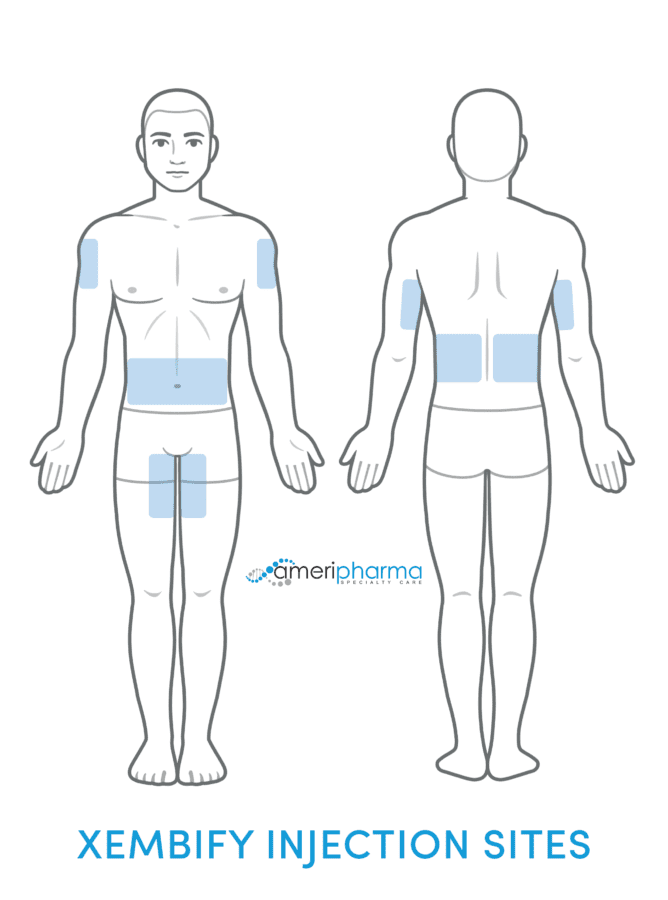
防范措施
怀孕
尚无人体数据显示是否存在药物相关风险。尚未对 Xembify 进行动物生殖研究。尚不清楚该药物在孕妇服用后是否会对胎儿造成损害或影响生殖能力。
哺乳期母亲
目前尚无人类数据显示该药物是否存在相关风险。应考虑母乳喂养对婴儿发育和健康的益处,以及母亲对Xembify的临床需求,以及该药物对母乳喂养婴儿的任何潜在不良影响。
儿科用途
一项多中心临床试验评估了Xembify在14名患有PI的儿科受试者(2至16岁)中的疗效。其安全性和有效性与成人受试者相似。无需针对儿童的特定剂量即可达到所需的血清IgG水平。Xembify在2岁以下儿科患者中的安全性和有效性尚未确定。
老年人使用
Xembify 的临床研究纳入的 65 岁以上受试者数量不足,因此无法确定他们的反应是否与年轻受试者不同。参与临床试验的三名受试者年龄均为 65 岁及以上。一般而言,老年患者的剂量选择应谨慎,通常从剂量范围的低端开始。
成本
Xembify 的成本约为 $188(供应量为 5 毫升)。
获取您的 IVIG 剂量
在家输液共同支付援助
共同支付援助计划 适用于 Xembify,符合条件的患者可支付 $0。这些项目提供的共付额援助金额为每年 $5,000 至 $10,000。
患者需要提出申请,以查看他们是否符合获得共付额援助的条件。
Xembify 使用警告
医生会根据评估结果,决定 Xembify 是否适合您。如果您有以下情况,请告知医生:
- 有心血管(心脏)问题
- 久坐不动的生活方式导致血液粘稠度过高
- 放置永久性静脉导管
- 正在服用任何含有雌激素的药物
- 患有肾功能障碍
- 有以下危险因素 血栓形成
存在血栓风险的患者应格外谨慎治疗。在这种情况下,医生可能会开具最低剂量和较低输注速度的Xembify。
警告和注意事项
超敏反应
人类可能会发生严重的过敏反应 免疫球蛋白 产品,包括Xembify。如果发生超敏反应,应立即停止Xembify输注并采取适当的治疗。
Xembify 含有 IgA。已知存在抗 IgA 抗体的患者发生潜在严重超敏反应和/或过敏反应的风险更高。Xembify 禁用于 IgA 缺陷、存在抗 IgA 抗体且有人类免疫球蛋白治疗过敏史的患者。
血栓形成
使用免疫球蛋白产品(包括 Xembify)治疗后可能会发生血栓形成。
风险因素:
- 高龄
- 长时间固定
- 高凝状态
- 静脉/动脉血栓形成病史
- 使用雌激素
- 留置中心血管导管
- 高粘滞血症
- 心血管因素
在没有已知风险因素的情况下也可能发生血栓形成。
考虑对有高粘血症风险的患者进行血液粘度基线评估,包括患有冷球蛋白、空腹乳糜微粒血症/甘油三酯明显升高的患者,或 单克隆丙种球蛋白病. 对于有血栓形成风险的患者,以可行的最小剂量和输注速率给予 Xembify。
确保患者在给药前充分补充水分。监测血栓形成的体征和症状,并评估有高粘血症风险的患者的血液粘度。
无菌性脑膜炎综合征(AMS)
已有报道显示,使用静脉注射或皮下注射人免疫球蛋白可导致急性高山综合征 (AMS)。该病通常在免疫球蛋白治疗后数小时至2天内发病。女性AMS的发病率可能高于男性。
症状:
- 严重头痛
- 颈项强直(颈部僵硬)
- 睡意
- 发烧
- 畏光(对光敏感)
- 眼球运动疼痛
- 恶心
- 呕吐
脑脊液 (CSF) 研究经常显示脑脊液细胞增多,最多可达每立方毫米数千个细胞,主要来自粒细胞系列,蛋白质水平升高至数百毫克/分升,但培养结果为阴性。
为了排除脑膜炎的其他原因,对出现症状的患者进行彻底的神经系统检查,包括脑脊液研究。
急性高山综合征 (AMS) 可能更常与高剂量(>2 g/kg)和/或快速输注免疫球蛋白制品有关。停止免疫球蛋白治疗可导致 AMS 在数天内缓解,且无后遗症(后遗症)。
获得 IVIG 共同支付援助
IVIG 财务援助肾衰竭和溶血
使用人免疫球蛋白产品,尤其是含蔗糖的产品,可能会导致急性肾功能障碍/衰竭、急性肾小管坏死、近端肾小管肾病、渗透性肾病甚至死亡。Xembify 不含蔗糖。请确保患者在服用 Xembify 前未出现血容量不足的情况。
处于危险中的患者
有发生肾功能障碍风险的患者包括已存在任何程度肾功能不全或易患急性肾衰竭的患者,例如:
- 糖尿病
- 年龄超过 65 岁
- 容量不足
- 脓毒症
- 副蛋白血症
- 接受已知肾毒性药物
对于此类患者,应监测肾功能并考虑降低剂量、增加剂量频率。
对于有潜在急性肾衰竭风险的患者,定期监测肾功能和尿量尤为重要。评估肾功能,包括测量 血尿素氮 初次输注前及之后适当间隔,应检测尿素氮(BUN)/血清肌酐。如果肾功能恶化,请考虑停用Xembify。
溶血
IgG产品(包括Xembify)可能含有血型抗体,这些抗体可作为溶血素,并在体内诱导红细胞(RBC)被免疫球蛋白覆盖,导致直接抗球蛋白(Coombs')试验阳性和溶血。由于红细胞滞留增强,人免疫球蛋白治疗后可能出现迟发性溶血性贫血,并且已有报道出现与血管内溶血一致的急性溶血。
监测Xembify接受者的溶血临床体征和症状,尤其是具有非O型血或接受高剂量IgG(≥ 2 g/kg)等风险因素的患者。个别患者的潜在炎症状态可能会增加溶血风险,但其作用尚不明确。
如果 Xembify 输注后出现溶血的体征和/或症状,请进行适当的确认性实验室检测。
输血相关急性肺损伤(TRALI)
接受人免疫球蛋白产品治疗的患者可能出现非心源性肺水肿。TRALI 的特征是严重的呼吸窘迫、肺水肿、低氧血症、左心室功能正常和发热。症状通常在治疗后 1 至 6 小时内出现。
监测患者的肺部不良反应。如果怀疑患有严重肝损伤 (TRALI),应进行适当的检测,以确定产品和患者血清中是否存在抗中性粒细胞抗体和抗人类白细胞抗原 (HLA) 抗体。TRALI 可通过氧疗和呼吸机支持进行治疗。
干扰实验室测试
输注Xembify后,患者血液中多种被动转移抗体的短暂升高可能导致血清学检测结果呈假阳性,并可能造成误导性解读。请务必告知医生您的治疗方案。
传染源的传播
由于Xembify由人血制成,因此可能存在传播传染性病原体(即病毒)、变异型克雅氏病(vCJD)病原体以及克雅氏病(CJD)病原体的风险。这也适用于未知或新出现的病毒和其他病原体。
目前尚未有使用 Xembify 传播克雅氏病或任何其他病毒性疾病的病例报告。
非严重副作用
对 Xembify 给药的当地反应包括:
- 输液部位红斑(发红)
- 输液部位疼痛
- 输液部位肿胀
- 输液部位瘀伤
- 输液部位瘙痒
- 输液部位硬结(硬度)
- 输液部位结痂
- 输液部位水肿
- 全身反应(如咳嗽和腹泻)
临床试验中超过5%名受试者最常见的不良反应是局部不良反应。
向 IVIG 专家咨询副作用
药物相互作用
减毒活病毒疫苗
抗体的被动转移会暂时干扰人体对活病毒疫苗的免疫反应,例如:
- 腮腺炎
- 麻疹
- 风疹
- 水痘
您应该在接种疫苗之前告知您的医疗保健提供者任何最近的 Xembify 治疗,以便采取适当的预防措施。
血清学检测
免疫球蛋白制剂中的各种被动转移抗体(包括 Xembify)可能会混淆血清学检测的结果。